初発膠芽腫について
【オプチューンの有効性】
-初発膠芽腫に対して-
オプチューン+テモゾロミド併用治療群において、オプチューンの使用時間が長いほど長期生存ベネフィットが増加したとの報告があります。
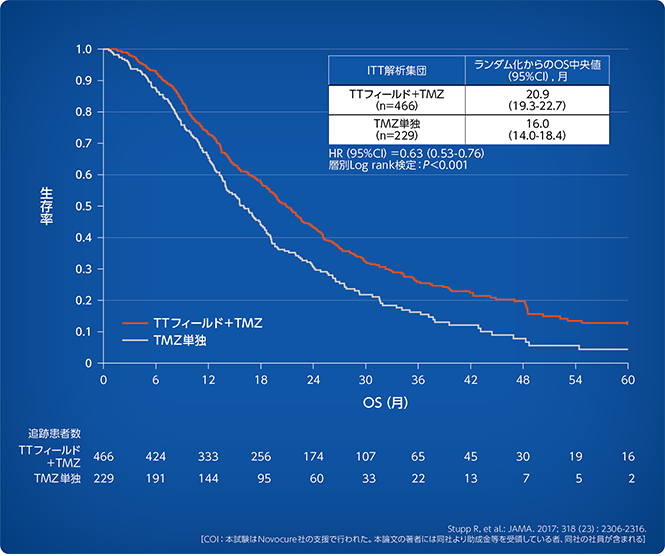

オプチューン+テモゾロミド併用治療群の方がテモゾロミド単独治療群よりも有意に高い2年生存率を示し、5年生存率もその有意差を維持したとの報告があります。¹
OSが有意に延長
オプチューン+テモゾロミド併用治療群の5年生存率は13%、一方テモゾロミド単独治療群は5%でした。
オプチューン+テモゾロミド併用治療群のOS中央値はテモゾロミド単独治療群よりも約5カ月延長しました。 (P<0.001)¹
PFSもオプチューン+テモゾロミド併用治療群がテモゾロミド単独治療群に対して有意差を示しました¹
- オプチューン+テモゾロミド併用治療群のPFS中央値は6.7カ月、一方テモゾロミド単独治療群は4.0カ月でした。 (P<0.001)
月間オプチューン使用率が高いほど長期生存ベネフィットが増加したとの報告があります。³
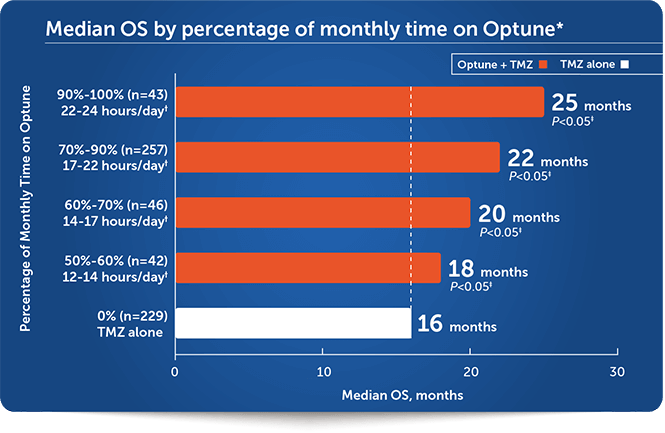
- ★オプチューンの月間使用時間に基づきます。こちらのデータは治療開始月から6カ月間のオプチューン使用時間平均を反映しています。⁴
- †月間の概算使用時間を1日の使用時間に換算
- ‡対照群はテモゾロミド単独治療群
- 月間使用時間はKPS、年齢、MGMTメチル化等とは独立した生存ベネフィットの予測因子でした。³
 |
の患者が1日の50%以上オプチューンを使用し、オプチューンの生存ベネフィットを享受しています。 (n=388/450)³(2018年現在) |
このようなエビデンスから長期使用が推奨されます

NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®)において初発テント上膠芽腫でパフォーマンスステータスが良好*な患者の治療にオプチューン+テモゾロミド併用治療がカテゴリー1で推奨されました。¹
ガイドライン中、オプチューンは「alternating electric field therapy」と表記されています。
MGMT, O-6-methylguanine—DNA methyltransferase; OS, overall survival; PFS, progression-free survival.
*NCCNガイドラインでは良好なパフォーマンスステータスをKPS 60以上と定義しています。一方臨床試験ではKPS 70以上が選択基準の1つでした。
National Comprehensive Cancer Network(NCCN)は内容、使用、適用に関して一切保証するものではなく、また適用や使用に関しても一切責任を負いません。
“脳腫瘍診療ガイドライン 2019年版”(特定非営利活動法人 日本脳腫瘍学会 編集/一般社団法人日本脳神経外科学会 監修)には下記の記述があります。
[以下抜粋]
CQ5膠芽腫に対する、交流電場腫瘍治療システム(NovoTTF-100Aシステム)の使用は有効か?
推奨初発テント上膠芽腫に対して、手術と化学放射線療法の初期治療後、化学療法の維持療法時に交流電場腫瘍治療システム(NovoTTF-100Aシステム)の使用追加を考慮する。 [推奨グレードB]
解 説
交流電場療法は、有糸分裂中の細胞を標的とした2方向の腫瘍治療電場(tumor treatment fields:TTF)を順次印加する治療法である。この交流電場が有糸分裂中期の核分裂停止を誘発し、有糸分裂後期から終期に、高分子/細胞小器官を細胞分裂溝に押しやり、構造的破壊を誘発するという。交流電場療法の効果は方向性や強度および周波数に依存し、基礎実験では膠芽腫の適正周波数は200kHz で強度は≥1V/cmであった¹。臨床的に最低4週間効果的な治療を継続する必要があると考えられている。 初発テント上膠芽腫患者において、NovoTTF-100A システム + テモゾロミド(TMZ)治療をTMZ単独治療と比較する第III相試験(EF-14)が実施された。標準治療であるTMZ併用化学放射線療法の初期治療の4~7週間後に2対1にランダム化割り付けされ、NovoTTF-100A システム + TMZ維持治療6クール群(試験群)と、TMZ維持治療6クール群(対照群)の治療を行った。初回再発後、試験群はNovoTTF-100A システム +セカンドライン治療(化学療法±手術±定位放射線治療)、対照群はセカンドライン治療を24カ月後あるいは2度目の増悪まで施行した²。試験は315例(210例vs 105例)を対象とした中間解析の結果、米国FDAから早期の有効中止を勧告された。最終的に695例(466例vs 229例)が解析対象となり、主要評価項目であるランダム化からの無増悪生存期間中央値が、試験群7.2カ月が対照群4.0カ月と比較し有意に長かった(HR = 0.621,p = 0.0013)。また副次評価項目である全生存期間中央値も試験群が20.5カ月で、対照群の15.6カ月と比較し有意に長く(HR = 0.666,p = 0.0042)、2年生存割合も有意に高かった(48% vs 32%, p = 0.0058)。また,試験群は対照群と比較し重篤な有害事象発生の有意な増加はなく、最も一般的(≥ 10%)な有害事象は、血小板減少症、貧血、便秘、嘔吐、疲労、医療機器装着部位の反応、頭痛、痙攣、鬱状態であり、NovoTTF-100A システムに関連した最も一般的な有害事象は、軽度から中等度の皮膚有害事象だった²(レベルIb)。 これらの結果より、オープン試験という批判はあるものの前方視的ランダム化試験によって無増悪生存期間中央値、全生存期間中央値ともに有意な延長を示した治療法であり、米国のNCCN®ガイドラインで初発膠芽腫の標準治療の選択肢として推奨されている(カテゴリー2A)。我が国での臨床経験は少ないものの、物理力を使用した治療法であるため、薬剤のような人種特有の有害事象は考えにくい。医療経済の議論はあるが、初発膠芽腫患者での使用が推奨される。 EF-14試験に先立ち、237例の再発膠芽腫患者に対してランダム化第III相試験(EF-11試験)が施行された。NovoTTF-100A システム単独群(120例)と医師選択の化学療法群(117例)を多施設でランダム化比較したところ、生存期間中央値が試験群6.6カ月、対照群が6.0カ月と有意差を認めなかった(p = 0.27)³(レベルIb)。NovoTTF-100A システムの優越性は証明できなかったものの、効果が同等であった化学療法と比較して有害事象が軽度であり、日米両国で再発膠芽腫を適応に薬事承認された。 この米国承認後にNovoTTF-100A システムを使用した457人の再発膠芽腫患者に関する市販後調査(PRiDe試験)報告がある。交流電場腫瘍治療システムによる生存の明確な予後予測因子はコンプライアンスであり、1日あたり18時間以上の使用群が18時間未満群と比較し生存期間が長かった。また、初回再発群が2回目や3回目以上再発群と比較し成績が良好であった⁴(レベルIII) 以上から、再発膠芽腫患者については、交流電場腫瘍治療システムが治療選択肢の一つと考えられる。
<注意> 交流電場腫瘍治療システム (NovoTTF-100A システム):薬事承認されているが、再発膠芽腫への保険適用外(自費)
◆文献
1 Kirson ED, Dbaly V, Tovarys F, et al. Alternating electric fields arrest cell proliferation in animal tumor models and human brain tumors. Proc Natl Acad Sci USA. 2007; 104(27) : 10152-7.[PMID:17551011]
2 Stupp R, Taillibert S, Kanner AA, et al. Maintenance therapy with tumor-treating fields plus temozolomide vs temozololmide alone for glioblastoma: a randomized clinical trial. JAMA. 2015;314(23):2535-43.[PMID:26670971](レベルIb)
3 Stupp R, Wong ET, Kanner AA, et al. NovoTTF-100A versus physician's choice chemotherapy in recurrent glioblastoma: a randomised phase III trial of a novel treatment modality. Eur J Cancer. 2012;48(14):2192-202.[PMID:22608262](レベルIb)
4 Mrugala MM, Engelhard HH, Dinh Tran D, et al. Clinical practice experience with NovoTTF-100A™ system for glioblastoma: The Patient Registry Dataset (PRiDe). Semin Oncol. 2014;41(5)(suppl 6):S4-S13.[PMID:25213869](レベルIII)
[以上抜粋]
※ノボキュア注記※「米国のNCCN®ガイドラインで初発膠芽腫の標準治療の選択肢として推奨されている(カテゴリー2A)。」の箇所については、2018年にカテゴリー1に昇格しています。
